
糖尿病的围术期管理
引言
糖尿病是一种高发性疾病,全球18岁以上人群中糖尿病患者数高达4.25亿,据国际糖尿病联盟(International Diabetes Federation,IDF)预计,到2045年,糖尿病发病率将提高48%[1]。因此,需要外科手术的患者中相当一部分会合并糖尿病,这将给围术期的管理带来挑战。此外,手术尚可诱发应激相关性高血糖,即血糖生成增加和暂时性的胰岛素抵抗[2]。确切证据证实,围术期(术前和术后)高血糖与手术并发症和死亡率增高相关,此外,手术患者血糖的优化管理与预后改善相关。
降低围手术期风险的血糖指标
术前目标
多数术前目标血糖的数据来源于心胸外科专业的观察性研究。这些研究证实,当术前糖化血红蛋白(HbA1c)>6.5%和>7%时,手术并发症(包括手术相关并发症、感染、ICU住院时间和总住院时间)发生率及5年死亡率提高(3.4)。一项对冠脉搭桥手术(CABG)患者的研究发现,患者术前HbA1c>8.6%时,患者死亡和发病风险(包括心肌梗塞、脑血管意外、切口感染)增加4倍[5]。这些数据表明,在心脏外科术后患者队列中,从相对较低水平即HbA1c>7%开始,HbA1c与并发症发生率呈正向线性相关。
在非心脏手术人群中,Underwood等研究了449例接受常规手术和血管外科手术的糖尿病患者,以非糖尿病患者为对照组,结果表明HbA1c>8%与住院时间延长有关[6]。在对接受关节置换和脊柱关节融合术的糖尿病患者进行的研究中,HbA1c≥7%或者血糖≥126 mg/dL与手术部位感染风险增加有关[7-9]。
基于心脏和非心脏手术患者数据,许多指南建议术前HbA1c>8.5%~9%的患者推迟非急诊的择期手术,以降低死亡风险[10,11],以HbA1c>7%为血糖控制目标,可降低手术风险。中华医学会麻醉分会的建议与此类似,HbA1c>8.5%时,临床医生应考虑推迟外科手术[12]。这些指南进一步强调需要根据患者近期(3个月内)HbA1c水平,对患者进行更合理的风险分层。然而对于这一点,我们必须强调,目前还没有前瞻性随机对照研究证实,将HbA1c降至“最佳”水平能够降低术后并发症发生率和死亡率,还有待进一步研究。
术后目标
与术前目标血糖的研究不同,已有随机临床试验(RCTs)证实,改善术后血糖水平有利于患者预后,特别是在ICU病房。
在过去的20年里,许多RCTs观察了在ICU病房接受强化治疗和传统胰岛素治疗的患者结局。Van den Berghe等证实,在大部分心脏手术后的ICU患者中,与180~200 mg/dL的常规血糖控制目标相比,将血糖控制目标设定在80~110 mg/dL,可降低并发症发生率,住院死亡率下降34%,其中,与脓毒症相关的多器官功能衰竭患者死亡率下降最为明显[13]。这些结果引起了GLUCO-CABG和NICE-SUGAR试验的质疑。纳入内科和外科患者的NICE-SUGAR试验不仅未能证实强化血糖控制(81~108 mg/dL)的益处,反而强化组中出现与低血糖发生率增高相关的90天死亡率提高[14]。然而,这些数据并不能说明传统治疗没有问题,因为因果分析显示两组均有相当数量的低血糖和死亡事件发生[15]。在对冠状动脉旁路移植术后患者进行的GLUCO-CABG试验中,与对照目标血糖141~180 mg/dL相比,强化血糖控制目标(100~140 mg/dL)时,患者并发症发生率和死亡率并无差异[16]。
虽然不同试验的目标血糖范围、营养和人口统计资料有差别,但低血糖已引起高度重视,内分泌和麻醉协会建议术后血糖控制应适度。美国糖尿病协会(American Diabetes Association,ADA)最新指南推荐在监护病房,患者目标血糖应该维持在140~180 mg/dL[17]。中华医学会麻醉学分会、法语地区糖尿病学会和英国糖尿病联合会均推荐术后住院患者目标血糖控制在<180 mg/dL[11,12,18]。
除监护病房外,多数术后血糖控制和术后结局关系的数据来源于回顾性研究。波特兰糖尿病项目(Portland Diabetic Project)证实CABG术后血糖>200 mg/dL与感染率和死亡率增高有关,而持续胰岛素静脉输注使血糖控制在<150 mg/dL,死亡率和感染率均下降[19]。华盛顿州手术护理和结局评估项目同样表明,非心脏手术后血糖>180 mg/dL与并发症(感染、再手术)和死亡率(优势比2.71)提高有关[20]。与此类似,其他回顾性研究表明心脏和非心脏手术后,当血糖>200 mg/dL时,死亡率和并发症发生率(感染、肾功能衰竭、心肌梗塞等)提高[5,21,22]。这些数据表明非监护病房术后患者血糖在180~200 mg/dL以上时预后更差。所以,ADA建议非危重症患者的目标血糖为140~180 mg/dL,对于低血糖风险相对低的患者,建议将目标血糖控制为相对低的110~140mg/dL[17]。中国指南进一步建议入院前长期血糖未控制的高血糖患者应该将空腹血糖控制在≤180 mg/dL,随机血糖控制在≤216 mg/dL[12]。其目的是避免围手术期血糖降得太快而造成危害。
综合考虑
当患者术前HbA1c>8.5%~9%或者术后血糖>180~200 mg/dL时,为了降低术后并发症和死亡率,必须特别重视血糖的控制。目标血糖管理建议总结见表1。然而,来自ICU的可靠数据也警示存在强化血糖控制引起的低血糖事件所带来的显著危害,因此,必须注意维持术后血糖的平衡

Full table
药物治疗
糖尿病的非胰岛素药物治疗
许多糖尿病治疗药物可以维持至术前1天或者手术当日。然而,不同国家和组织提出的指南不同,对于如何在术前和术后使用这些药物还缺乏共识。有关以下药物的使用建议,请参阅表2。
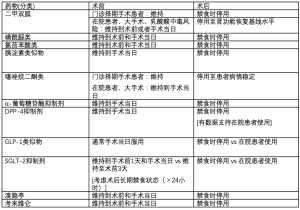
Full table
二甲双胍:理论上应关注二甲双胍应用于心、肝、肾功能不全或接受含碘造影剂的患者时,可引起药物相关性乳酸酸中毒[23,24]。然而,这很罕见,目前并无证据支持与二甲双胍使用相关的系统性并发症发生率和死亡率增加[25]。总之,对于肾功能完好的门诊择期手术患者,药物治疗甚至可维持到手术当日。对于有围手术期乳酸酸中毒风险因素或者大手术患者,手术前1天和手术当日应服用最低剂量的二甲双胍[11,18,26,27]。如果患者术后出现肾功能损害,在患者肾功能恢复到基线水平后方可使用二甲双胍。
磺酰脲类(SFU):由于禁食状态下存在低血糖风险,手术日早晨应该停用磺酰脲类药物。某些磺酰脲类药物代谢产物存在生物活性,可造成低血糖,且清除情况无法预测,进一步加剧了长期低血糖的风险[28,29]。相比之下,胰岛素虽具有相似的低血糖效应,但其代谢过程可预测。磺酰脲类药物除了低血糖外还有其他风险。它们不仅作用于胰腺β细胞ATP依赖的钾通道使其释放胰岛素,还能影响心肌细胞的钾通道,导致心肌细胞的缺血预处理被阻断[30,31]。有指南推荐在手术前24小时停用磺酰脲类药物(即维持到手术前1天)。在医院内,尚无确切证据支持将这类药物作为糖尿病的首选治疗方案。当患者可经口进食时,应该考虑恢复原来的治疗方案。
氯茴苯酸类:类似于SFU类药物,由于患者在禁食状态下存在低血糖风险,这类药物应该以最小剂量维持。重要的是,它们对钾通道有类似于SFU类药物的作用。所以,有指南推荐此类药物也应维持至术前1天。如果术后恢复经口进食,可以考虑恢复服用。
胰淀素类似物:这类类似物中唯一可用的制剂是普兰林肽,餐前静脉注射。因为其作用机制是影响餐后高血糖,当患者禁食时应予以维持。类似于其他药物,它有明显的消化道不良反应,与胰岛素联合用于1型糖尿病患者时,也有发生显著低血糖的风险[32]。当患者能够耐受经口进食,可以恢复原来的治疗方案。
噻唑烷二酮类:因为可引起液体潴留这一不良反应,这类药物常在术晨停用,但对门诊择期手术患者可以继续使用。术后患者情况稳定时可以恢复使用[11,18]。
α-葡萄糖苷酶抑制剂:这类药物通过阻断肠道对糖类的吸收而发挥作用,因此在患者禁食状态无效。它们也会引起消化道不良反应,术后可能会加剧[11,18]。术后患者病情稳定时可以考虑恢复使用。
DPP-4抑制剂:这类药物针对餐后高血糖,在禁食状态作用不大。然而,有可靠的证据支持这类药物在降低院内血糖方面的效果和安全性,特别是在联用基础胰岛素时。当患者可以耐受术后经口进食时,可以恢复使用。
GLP-1类似物:类似于DPP-4抑制剂,此类药物旨在降低餐后血糖,对夜间/空腹血糖也有一定影响。如果每天服用的话应该维持到手术当天,因为此类药物可导致严重的恶心症状,影响术后营养。对于每周服用1次的剂型,正常服用;如果刚好需要在手术当日服用,则推迟至术后恢复经口进食或停用。此类药物有可能引起显著的消化道不良反应,术后可能会加剧[11,18]。
SGLT-2抑制剂:美国食品药品监督管理局于2015年首次发布了安全性声明,指出此类药物存在血糖正常的糖尿病酮症酸中毒风险[33]。因此,大多数协会推荐此类药物在术晨应最小剂量维持。然而,即使术前48小时停用此类药物,仍可导致血糖正常的糖尿病酮症酸中毒,因此,一些建议倾向于术前3天停药[34]。饮食急剧减少似乎是血糖正常的糖尿病酮症酸中毒重要的触发因素,因此,有人推荐使用SGLT-2抑制剂时应根据患者特征和手术类型,并重点考虑患者术后无热量摄入时间[35]。总之,这类药物虽然在某些情况下可以使用,但目前仍不推荐在医院使用[17,36]。
溴隐亭:由于使用相对较少,关于此类药物在围术期应用的推荐就更少。这类药物通过提高胰岛素敏感性起作用,有潜在的胃肠道不良反应,通常与食物同服。其半衰期大约为6小时,术前24小时和禁食期间停用[37]。
考来维仑:类似于溴隐亭,此药很少使用,几乎没有专家推荐在围手术期使用该药物。它是胆汁酸鳌合剂,已经证实可以改善血糖控制。有潜在的胃肠道不良反应,术前24小时和禁食期间停用。
对于近期(1~2天内)即将出院患者,应尝试恢复其以前使用过的口服药,除非患者出现一种或多种药物使用禁忌,同时考虑到特定医院有关口服药物的政策,及药物是否在该院处方集中[11,18,23,26]。这可提供在门诊环境中合理管理血糖的额外信息。对于术前血糖控制不佳的患者(即3个月内HbA1c>7%),出院前应进一步做好血糖管理的药物调整。
胰岛素使用的管理
在医院,胰岛素仍是糖尿病的主要治疗方法。围术期糖尿病患者可分为既往在使用胰岛素患者和初始使用胰岛素患者。表3概括了各种胰岛素类型,以及起效时间和持续时间,并分为基础剂型和餐前剂型,以供后续讨论参考[40,41]。为方便讨论,基础胰岛素即患者禁食状态血糖控制所需的胰岛素,餐前胰岛素即短效的用于管理餐后血糖的胰岛素(即覆盖用餐时间)和(或)矫正胰岛素(即将血糖降至目标水平所需的胰岛素)。
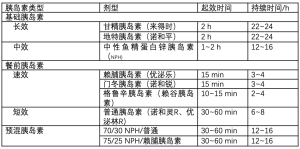
Full table
既往在使用胰岛素
术前已经在使用胰岛素的患者不应该停用,但需要进行剂量调整(表4)。

Full table
术前访视时,要了解清楚患者的一些重要信息。首先,应知晓其使用的胰岛素类型、剂量、通常给药时间。注意基础胰岛素、膳食胰岛素是否各占约50%。其次,应了解治疗方案对血糖的控制情况和低血糖事件的发生状况,特别要注意低血糖事件以及发生时间。夜间低血糖提示基础胰岛素量过大,术前需要减少基础用量。如果确定基础胰岛素量能准确控制禁食状态下肝脏葡萄糖的输出量,可以给予全剂量。实际上,根据患者的正常剂量模式,应该减少20%~25%的早/晚用长效基础胰岛素剂量。对于中效中性鱼精蛋白锌胰岛素(neutral protamine Hagedorn,NPH),术晨可给予正常剂量的一半。对于预混胰岛素,有两种使用方案:一种是术前1天增加预混胰岛素的剂量,术晨给予一半剂量的长效基础胰岛素;另一种方法是出于患者经济和人力资源方面的考虑,可在术晨给予预混胰岛素日总剂量的一半。然而,也要特别小心预混胰岛素中含有速效胰岛素成分,所以预混胰岛素比中效胰岛素更易发生低血糖。
关于餐时胰岛素,应该给予正常的剂量直至禁食。如果有餐时胰岛素过量的证据,应该考虑减少术前1天的餐时胰岛素,特别是禁食前最后一餐[11,18,40,42]。
手术后,已经减少的基础胰岛素剂量应该持续使用至恢复经口进食。同样,餐时胰岛素应该在恢复经口进食时使用。可考虑单独使用胰岛素校正量表,直至有稳定的膳食摄入[40,42,43]。
为了计算校正范围内的胰岛素敏感性(即每单位胰岛素的预计血糖改善量),有以下几种方法可以使用。依照“1800法则”,对于已经使用胰岛素的患者,胰岛素敏感性为1 800/每日胰岛素总剂量。对于没有使用胰岛素或每日总剂量未知的患者,敏感性约为40[23]。这些敏感性应该进一步调整,以考虑可能的低血糖,也可以作为显著胰岛素抵抗的证据[44]。
胰岛素首次使用
即使患者以前没有使用过胰岛素降血糖,胰岛素也是医院中饮食清淡的患者的首选治疗方法。已有许多RCT研究评估在院糖尿病患者的胰岛素治疗方案。RABBIT2外科试验证实,在糖尿病术后人群使用基础和餐时胰岛素的治疗方案,相较于只用矫正胰岛素方案,血糖控制更好、术后并发症更少。在试验中,如果血糖为140~200 mg/dL,基础胰岛素剂量是0.20 U/(kg·d);如果血糖持续>200 mg/dL,则是0.25 U/(kg·d)[45]。对于年龄>70岁和(或)肾功能不全的患者,降低以体重为基础的胰岛素使用量,一些指南推荐半量使用。详见表5。

Full table
术后重症监护病房胰岛素使用
大量数据支持在重症监护病房使用电脑列线图静脉输注胰岛素[19-23]。当术后转换为皮下使用时,恰当过渡很重要。术前已在家使用长效胰岛素治疗的患者无需过渡。对于术前没有使用胰岛素的患者,静脉注射胰岛素应该持续至长效基础胰岛素使用后2小时。基础胰岛素推荐剂量如前所述[46]。
术中血糖管理
术中作为术前和术后的“桥接时期”,虽然较术前、术后时间短暂,但血糖变动大。因为患者是否能从术中血糖控制获益不确定,同时缺乏静脉注射胰岛素和频繁血糖监测的条件。
术中血糖管理的研究表明,当使用胰岛素处理术中血糖时,不良结局如感染或通气时间延长会缓解[47,48]。目前已有研究采用术中联合输注葡萄糖和胰岛素的方法,来降低心肌梗塞术中低血糖的发生并提供代谢底物。其他外科手术中也采用此类方法。在心胸外科手术中,相较于静脉输注胰岛素使血糖控制在70~150 mg/dL,静脉输注葡萄糖和胰岛素使血糖控制在80~110 mg/dL时,至少以下一种并发症的相对危险度为0.62(95% CI:0.39~0.97):30天死亡率、机械辅助循环支持、感染、肾脏或神经系统并发症发生率[49]。
由于存在诸多益处,不同协会的指南推荐术中每小时监测1次血糖,目标血糖值如下:法国麻醉和重症医学协会为80~180 mg/dL[50],大不列颠和爱尔兰麻醉医师协会为108~180 mg/dL[51],中华医学会麻醉分会为140~180 mg/dL[11]。然而,在临床实践中,指南的依从性并不一致。一项研究发现,全国术中血糖监测依从性差,仅56%的患者接受每小时血糖监测[52]。虽然严重低血糖实际发生率<1%,麻醉医生仍因顾虑低血糖风险,而不愿在手术室中实施降糖措施[49,53]。
综上所述,术中血糖的控制与管理和术前、术后同等重要,需要格外关注。
特别注意:围术期使用胰岛素泵
在围术期需特别注意胰岛素泵(持续皮下注射胰岛素(continuous subcutaneous insulin infusions,CSII))的使用。一般来说,患者自己必须能够正确使用和管理胰岛素泵。尽管某些情况下,术中镇静时仍可以使用胰岛素泵,这部分内容将在本节中讨论。极少有数据关注围手术期胰岛素泵的使用。术前患者评估时,应该仔细了解胰岛素泵的使用情况:使用的胰岛素类型、持续时间、基础胰岛素和餐时胰岛素设置(碳水化合物比例及胰岛素敏感性因素)和目标血糖。应评估患者使用胰岛素泵的能力,特别是他们改变设置和执行操作(如临时基础率)的能力。为了评估基础速率的准确性,医务人员可考虑术前几天进行“基础试验”,即要求患者在禁食状态,自午夜开始,每3小时测1次血糖,直至预计的手术时间。关键是了解这期间向低血糖或高血糖偏移的情况,以及测定值间的差距>30 mg/dL时基础速率的变化情况。另外,由于很多患者基础速率超生理状态,这部分覆盖了他们一天的膳食摄入,建议禁食期间经验性降低20%的基础速率。
在很多情况下,术中不适宜携带胰岛素泵,大多数患者取掉了泵。这些情况包括除超声以外的外部成像(即X线、CT、MRI),重大或急诊手术,手术时间长(>2~4小时)和预计术后多次缺餐导致长期禁食状态。在这种情况下,应该术晨给予全天基础剂量80%的甘精胰岛素或者地特胰岛素,2小时后停用泵。紧急情况下可使用的替代办法是以泵中预定的基础速率开始静脉注射胰岛素,然后在半小时后关闭。术中和术后每次使用应该有胰岛素率滴定图。对于1型糖尿病患者,如果手术时间不到3~4小时,可以皮下注射胰岛素(赖脯胰岛素或者门冬胰岛素)以补充1~2小时的基础率缺失,术后立即恢复泵的使用。然而这不是首选,因为禁食状态下注射胰岛素存在低血糖风险。而对于2型糖尿病患者,短时手术可以直接暂停使用泵[55-56]。
如果患者带着泵进手术室(时间短的门诊择期手术),下午之前或上午可以改变注射部位,在术前测几次血糖,以确保设备功能正常。泵应该从手术部位移出,并在手术中方便麻醉团队使用。应该降低基础速率,术中、术后经常监测血糖(即每小时1次),恢复饮食后可恢复至术前状态[54-56]。
当患者的胰岛素泵已经移除,或随后由医疗团队,或根据患者的意愿决定术后移除(一般是因为患者精神状态改变),应该制定多次皮下注射或基础-推注胰岛素方案。如果患者静脉注射胰岛素,应该与皮下速效胰岛素有半小时重叠,与皮下基础胰岛素有2小时重叠。当恢复胰岛素泵(通常是患者清醒和耐受经口进食时)和给予基础胰岛素时,应该暂停基础速率,直至下次皮下注射基础剂量前1~2小时[54-56]。
结论
糖尿病围手术期管理的目的是减少手术并发症和降低死亡率。为此,可通过各种药物治疗来减少高血糖和低血糖的发生。尽管目前尚缺乏围术期血糖管理的共识及强有力的研究证据支持,通过对既往研究的回顾与总结,我们仍可达成一系列有关围术期糖尿病管理的推荐意见与建议。对于文中的一些经验性意见与建议,仍需未来进一步研究证实。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editors (Moises Auron, Christopher Whinney) for the series “Update in Perioperative Medicine” published in Journal of Xiangya Medicine. The article has undergone external peer review.
Conflicts of Interest: Both authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/jxym.2019.06.04). The series “Update in Perioperative Medicine” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- International Diabetes Federation. IDF Diabetes Atlas, 8th ed. Brussels, Belgium: International Diabetes Federation; 2017. Available online: http://www.diabetesatlas.org.
- Palermo NE, Gianchandani RY, McDonnell ME, et al. Stress Hyperglycemia During Surgery and Anesthesia: Pathogenesis and Clinical Implications. Curr Diab Rep 2016;16:33. [Crossref] [PubMed]
- Sato H, Carvalho G, Sato T, et al. The Association of Preoperative Glycemic Control, Intraoperative Insulin Sensitivity, and Outcomes after Cardiac Surgery. J Clin Endocrinol Metab 2010;95:4338-44. [Crossref] [PubMed]
- Halkos ME, Lattouf OM, Puskas JD, et al. Elevated Preoperative Hemoglobain A1c Level is Associated With Reduced Long-Term Survival After Coronary Artery Bypass Surgery. Ann Thorac Surg 2008;86:1431-7. [Crossref] [PubMed]
- Halkos ME, Puskas JD, Lattouf OM, et al. Elevated preoperative hemoglobin A1c level is predictive of adverse events after coronary artery bypass surgery. J Thorac Cardiovasc Surg 2008;136:631-40. [Crossref] [PubMed]
- Underwood P, Askari R, Hurwitz S, et al. Preoperative A1C and Clinical Outcomes in Patients With Diabetes Undergoing Major Noncardiac Surgical Procedures. Diabetes Care 2014;37:611-6. [Crossref] [PubMed]
- Hikata T, Iwanami A, Hosogane N, et al. High preoperative hemoglobin A1c is a risk factor for surgical site infection after posterior thoracic and lumbar spinal instrumentation surgery. J Orthop Sci 2014;19:223-8. [Crossref] [PubMed]
- Jämsen E, Nevalainen P, Kalliovalkama J, et al. Preoperative hyperglycemia predicts infected total knee replacement. Eur J Intern Med 2010;21:196-201. [Crossref] [PubMed]
- Cook KD, Borzok J, Sumrein F, et al. Evaluation and Perioperative Management of the Diabetic Patient. Clin Podiatr Med Surg 2019;36:83-102. [Crossref] [PubMed]
- Cheisson G, Jacqueminet S, Cosson E, et al. Perioperative management of adult diabetic patient. Review of hyperglycaemia: definitions and pathophysiology. Anaesth Crit Care Pain Med 2018;37:55-8.
- Joint British Diabetes Societies for inpatient care. Management of adults with diabetes undergoing surgery and elective procedures: Improving standards. 2016. Retrieved online: https://abcd.care/sites/abcd.care/files/resources/Surgical_guidelines_2015_full_FINAL_amended_Mar_2016.pdf.
- Chinese Medical Association Anesthesia Branch. J Clin Anesthesiol 2016;32:93-5. [Perioperative blood glucose management expert consensus (Abbreviated version)].
- van den Berghe D, Wouters P, Weekers F, et al. Intensive Insulin Therapy in Critically Ill Patients. N Engl J Med 2001;345:1359-67. [Crossref] [PubMed]
- NICE-SUGAR Study Investigators. Intensive versus Conventional Glucose Control in Critically Ill Patients. N Engl J Med 2009;360:1283-97. [Crossref] [PubMed]
- NICE-SUGAR Study Investigators. Hypoglycemia and Risk of Death in Critically Ill Patients. N Engl J Med 2012;367:1108-18. [Crossref] [PubMed]
- Umpierrez G, Cardona S, Pasquel F, et al. Randomized Controlled Trial of Intensive Versus Conservative Glucose Control in Patients Undergoing Coronary Artery Bypass Graft Surgery: GLUCO-CABG Trial. Diabetes Care 2015;38:1665-72. [Crossref] [PubMed]
- American Diabetes Association. Diabetes Care in the Hospital: Standards of Medical Care in Diabetes—2019. Diabetes Care 2019;42:S173-81. [Crossref] [PubMed]
- Cosson E, Catargi B, Cheisson G, et al. Practical management of diabetes patients before, during and after surgery: A joint French diabetology and anaesthesiology position statement. Diabetes Metab 2018;44:200-16. [Crossref] [PubMed]
- Furnary AP, Wu Y, Bookin SO. Effect of hyperglycemia and continuous intravenous insulin infusions on outcomes of cardiac surgical procedures: the Portland Diabetic Project. Endocr Pract 2004;10:21-33. [Crossref] [PubMed]
- Kwon S, Thompson R, Dellinger P, et al. Importance of Perioperative Glycemic Control in General Surgery. Ann Surg 2013;257:8-14. [Crossref] [PubMed]
- Frisch A, Chandra P, Smiley D, et al. Prevalence and clinical outcome of hyperglycemia in the perioperative period in noncardiac surgery. Diabetes Care 2010;33:1783-8. [Crossref] [PubMed]
- van den Boom W, Schroeder RA, Manning MW, et al. Effect of A1C and Glucose on Postoperative Mortality in Noncardiac and Cardiac Surgeries. Diabetes Care 2018;41:782-8. [Crossref] [PubMed]
- Duggan EW, Carlson K, Umpierrez GE. Perioperative Hyperglycemia Management: An Update. Anesthesiology 2017;126:547-60. [Crossref] [PubMed]
- Mercker SK, Maier C, Neumann G, et al. Lactic acidosis as a serious perioperative complication of antidiabetic biguanide medication with metformin. Anesthesiology 1997;87:1003-5. [Crossref] [PubMed]
- Duncan AI, Koch CG, Xu M, et al. Recent metformin ingestion does not increase in-hospital morbidity or mortality after cardiac surgery. Anesth Analg 2007;104:42-50. [Crossref] [PubMed]
- Duncan AE. Hyperglycemia and Perioperative Glucose Management. Curr Pharm Des 2012;18:6195-203. [Crossref] [PubMed]
- Meneghini LF. Perioperative management of diabetes: Translating evidence into practice. Cleve Clin J Med 2009;76:S53-9. [Crossref] [PubMed]
- Douros A, Yin H, Yu OHY, et al. Pharmacologic differences of sulfonylureas and the risk of adverse cardiovascular and hypoglycemic events. Diabetes Care 2017;40:1506-13. [Crossref] [PubMed]
- Krentz AJ, Bailey CJ. Oral antidiabetic agents: current role in type 2 diabetes mellitus. Drugs 2005;65:385-411. [Crossref] [PubMed]
- Garratt KN, Brady PA, Hassinger NL, et al. Sulfonylurea drugs increase early mortality in patients with diabetes mellitus after direct angioplasty for acute myocardial infarction. J Am Coll Cardiol. 1999;33:119-24. [Crossref] [PubMed]
- Tomai F, Crea F, Gaspardone A, et al. Ischemic preconditioning during coronary angioplasty is prevented by glibenclamide, a selective ATP-sensitive K+ channel blocker. Circulation 1994;90:700-5. [Crossref] [PubMed]
- Symlin (pramlintide) [package insert]. Wilmington, DE: AstraZeneca Pharmaceuticals LP; 2014.
- U.S. Food and Drug Administration. Drug Safety Communication: FDA warns that SGLT2 inhibitors for diabetes may result in a serious condition of too much acid in the blood. 15 May 2015. Available online: http://www.fda.gov/downloads/Drugs/DrugSafety/UCM446954.pdf.
- Lau A, Bruce S, Wang E, et al. Perioperative implications of sodium-glucose cotransporter-2 inhibitors: a case series of euglycemic diabetic ketoacidosis in three patients after cardiac surgery. Can J Anaesth 2018;65:188-93. [Crossref] [PubMed]
- Thiruvenkatarajan V, Meyer EJ, Nanjappa N, et al. Perioperative diabetic ketoacidosis associated with sodium-glucose co-transporter-2 inhibitors: a systematic review. Br J Anaesth 2019;123:27-36. [Crossref] [PubMed]
- Levine JA, Karam SL, Aleppo G. SGLT2-I in the Hospital Setting: Diabetic Ketoacidosis and Other Benefits and Concerns. Curr Diab Rep 2017;17:54. [Crossref] [PubMed]
- Shivaprasad C, Kalra S. Bromocriptine in type 2 diabetes mellitus. Indian J Endocrinol Metab 2011;15:S17-24. [Crossref] [PubMed]
- Handelsman Y. Role of Bile Acid Sequestrants in the Treatment of Type 2 Diabetes. Diabetes Care 2011;34:S244-50. [Crossref] [PubMed]
- Umpierrez GE, Reyes D, Smiley D, et al. Hospital discharge algorithm based on admission HbA1c for the management of patients with type 2 diabetes. Diabetes Care 2014;37:2934-9. [Crossref] [PubMed]
- Dobri GA, Lansang MC. How should we manage insulin therapy before surgery? Cleve Clin J Med 2013;80:702-4. [Crossref] [PubMed]
- Sebranek JJ, Lugli AK, Coursin DB. Glycaemic control in the perioperative period. Br J Anaesth 2013;111:i18-34. [Crossref] [PubMed]
- Joshi GP, Shung F, Rann MA, et al. Society for Ambulatory Anesthesia consensus statement on perioperative blood glucose management in diabetic patients undergoing ambulatory surgery. Anesth Analg 2010;111:1378-87. [Crossref] [PubMed]
- Demma LJ, Carlson KT, Duggan EW, et al. Effect of basal insulin dosage on blood glucose concentration in ambulatory surgery patients with type 2 diabetes. J Clin Anesth 2017;36:184-8. [Crossref] [PubMed]
- Duggan EW, Klopman MA, Berry AJ, et al. The Emory University perioperative algorithm for the management of hyperglycemia and diabetes in non-cardiac surgery. Curr Diab Rep 2016;16:34. [Crossref] [PubMed]
- Umpierrez GE, Smiley D, Zisman A, et al. Randomized study of basal-bolus insulin therapy in the inpatient management of patients with type 2 diabetes (RABBIT 2 trial). Diabetes Care 2007;30:2181-6. [Crossref] [PubMed]
- Jacobi J, Bircher N, Krinsley J, Agus M, et al. Guidelines for the use of an insulin infusion for the management of hyperglycemia in critically ill patients. Crit Care Med 2012;40:3251-76. [Crossref] [PubMed]
- Ehrenfeld JM, Wanderer JP, Terekhov M, et al. A Perioperative Systems Design to Improve Intraoperative Glucose Monitoring Is Associated with a Reduction in Surgical Site Infections in a Diabetic Patient Population. Anesthesiology 2017;126:431-40. [Crossref] [PubMed]
- Kang R, Han S, Kee JW, et al. Portland Intensive Insulin Therapy During Living Donor Liver Transplantation: Association with Postreperfusion Hyperglycemia and Clinical Outcomes. Sci Rep 2018;8:16306. [Crossref] [PubMed]
- Duncan AE, Sessler DI, Sato H, et al. Hyperinsulinemic Normoglycemia during Cardiac Surgery Reduces a Composite of 30-day Mortality and Serious In-hospital Complications: A Randomized Clinical Trial. Anesthesiology 2018;128:1125-39. [Crossref] [PubMed]
- Cheisson G, Jacqueminet S, Cosson E, et al. Perioperative management of adult diabetic patients. Intraoperative period. Anaesth Crit Care Pain Med 2018;37:S21-5. [Crossref] [PubMed]
- Membership of the Working Party. Peri-operative management of the surgical patient with diabetes 2015: Association of Anaesthetists of Great Britain and Ireland. Anaesthesia 2015;70:1427-40. [Crossref] [PubMed]
- Jackson MJ, Patvardhan C, Wallace F, et al. Perioperative management of diabetes in elective patients: a region-wide audit. Br J Anaesth 2016;116:501-6. [Crossref] [PubMed]
- Grunzweig K, Nair BG, Peterson GN, et al. Decisional practices and patterns of intraoperative glucose management in an academic medical center. J Clin Anesth 2016;32:214-23. [Crossref] [PubMed]
- Boyle ME, Seifert KM, Beer KA, et al. Guidelines for application of continuous subcutaneous insulin infusion (insulin pump) therapy in the perioperative period. J Diabetes Sci Technol 2012;6:184-90. [Crossref] [PubMed]
- Partridge H, Perkins B, Mathieu S, et al. Clinical recommendations in the management of the patient with type 1 diabetes on insulin pump therapy in the perioperative period: a primer for the anaesthetist. Br J Anaesth 2016;116:18-26. [Crossref] [PubMed]
- Simha V, Shah P. Perioperative Glucose Control in Patients With Diabetes Undergoing Elective Surgery. JAMA 2019;324:399-400. [Crossref] [PubMed]

陆森
独立完成普外科各种常规手术,尤其擅长肝移植、肝切除技术。常规开展腹腔镜下胆囊切除术.胆总管探查手术和腔镜肝切除技术,发表SCI文章多篇,主持和参与包括国家自然科学基金在内等多项课题,国家发明专利两项,分别排名: 第二,第四。(更新时间:2021/9/10)

李福祥
西部战区总医院重症医学科,医学博士,主任医师,硕士研究生导师。长期从事呼吸与危重症医学临床工作。现任中国医疗保健国际交流促进会创伤学分会常委,四川省医学会重症医学专委会副主任委员,四川省医师协会重症医师分会副会长。《中华肺部疾病杂志》等杂志编委。主持包括国家自然科学基金等在内的多项科研课题。主编、参编多部专著,发表论文70余篇。(更新时间:2021/9/10)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Zhou K, Lansang MC. Perioperative management of diabetes. J Xiangya Med 2019;4:28.


